Die vielfältige Rolle von TNF-Alpha bei Krebs
Einleitung
Tumornekrosefaktor (TNF) ist ein trimeres Typ-II-Transmembranprotein, das aus etwa 80 Aminosäuren besteht. Es verfügt über eine prolinreiche zytoplasmatische Domäne, die eine Rolle beim Membrantransport und bei der durch Rezeptorbindung ausgelösten reversen Signalübertragung spielt. Diese Domäne wird von einem einzelnen Transmembransegment und einer extrazellulären Domäne gefolgt, die die charakteristische TNF-Homologiedomäne (THD) enthält. Die THD ist über ein Stielsegment mit der Transmembranregion verbunden (Abbildung 1) (Bodmer et al., 2002). Aktivierte Immunzellen – insbesondere Makrophagen und T-Lymphozyten – sind die Hauptproduzenten von TNF. Allerdings sind auch andere Zelltypen wie Fibroblasten und Tumorzellen zur Synthese fähig (Wajant et al., 2003). Die biologischen Wirkungen von TNF werden hauptsächlich über zwei Rezeptoren vermittelt – TNFR1 und TNFR2. TNFR1 enthält eine Todesdomäne und kann Apoptose oder Nekrose einleiten, aktiviert aber auch pro-survivale Signalwege wie NFkB. TNFR2 besitzt keine Todesdomäne und fördert typischerweise Zellüberleben und Proliferation über NFkB-Signalwege. Beide Rezeptoren interagieren mit unterschiedlichen Adapterproteinen und Signalkaskaden, die zelluläre Ergebnisse beeinflussen (Apoptose, Überleben, Proliferation, Entzündung).
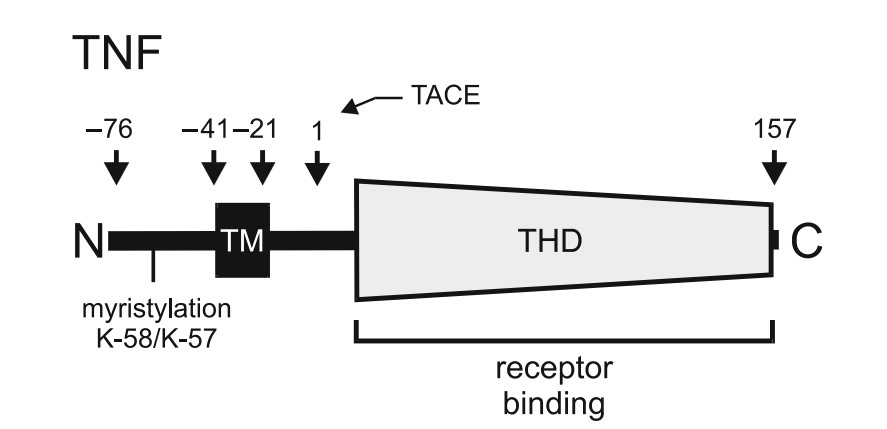
Abbildung 1: Menschlicher TNF. Die Aminosäurennummerierung bezieht sich auf die reifen Rezeptoren und das verarbeitete lösliche TNF. Myristylierte Lysinreste in TNF sind angegeben (Wajant, 2009).
Rolle von TNF bei Tumorsuppression und -förderung
Antitumorale Wirkungen
Anfangs wurde TNF als Zytokin charakterisiert, das Tumorzellen abtöten kann und therapeutisch bei isolierter Gliedmaßenperfusion mit Melphalan bei Weichteilsarkomen eingesetzt wurde (van Horssen et al. 2006). In dieser Anwendung erhöht TNF die Gefäßpermeabilität und erleichtert die Infiltration von Immunzellen und die Zerstörung von Tumoren. TNF kann auch Immunantworten stimulieren, die zur Entfernung von Tumorzellen beitragen. Die systemische Anwendung zeigte in präklinischen Modellen eine gewisse antitumorale Aktivität (van Horssen et al. 2006).
Pro-tumorale Wirkungen
Umgekehrt spielt TNF eine bedeutende Rolle bei der Tumorförderung und -progression. Zahlreiche experimentelle Modelle zeigen, dass TNF zur Karzinogenese beiträgt: Es fördert eine entzündliche Umgebung, die Tumorinitiation begünstigt (z. B. bei Hautkarzinogenese mit DMBA/TPA-Behandlung), unterstützt die Proliferation präneoplastischer Ovalzellen in der Leber und fördert das Tumorwachstum durch Aktivierung pro-survival- und pro-inflammatorischer Signalwege wie NFkB in Tumor- und Stromazellen (Arnott et al. 2002).
TNF in spezifischen Krebsarten und -stadien
Gastrointestinale Tumore: Bei Magenkrebs fördert die TNF-vermittelte Entzündung (häufig ausgelöst durch Helicobacter pylori) die Karzinogenese. TNF verstärkt die Tumorinfiltration und fördert die Angiogenese, was zum Tumorwachstum beiträgt (Popivanova et al. 2008).
Leber- und Hautkrebs: Bei der Leberkarzinogenese fördert die TNF-induzierte NFkB-Aktivierung in Hepatozyten die Zellproliferation und hemmt die Apoptose, was zur frühen Tumorentwicklung beiträgt. Ähnliche Mechanismen sind bei der Hautkarzinogenese beteiligt (Pikarsky et al. 2004).
Metastasierung und EMT: TNF fördert die Metastasierung in Modellen wie Kolon- und Pankreaskrebs durch Induktion der epithelial-mesenchymalen Transition (EMT), erhöht die Invasivität und verändert das Tumormikromilieu zugunsten der Verbreitung (Chuang et al. 2008).
TNF und tumorassoziierte Symptome
TNF ist nicht nur an Tumorwachstum beteiligt, sondern auch an tumorbedingten Symptomen wie Kachexie, krebsbedingten Schmerzen und Knochendestruktion. Es fördert die Osteoklastogenese, was zu Knochenschäden führt, und aktiviert Neuronen, die in die Schmerzübertragung involviert sind. TNF hemmt zudem die Differenzierung von Muskelzellen, was zu Muskelschwund und Erschöpfung bei Krebspatienten führt.
Die Rolle von TNF bei Krebs ist äußerst komplex – je nach Rezeptorbindung, Zellkontext und Tumormikroumgebung kann es sowohl tumorhemmend als auch -fördernd wirken. Therapeutische Strategien zielen darauf ab, seine vorteilhaften Wirkungen zu nutzen und gleichzeitig die tumorfördernden Aktivitäten zu verringern, was die Bedeutung einer präzisen Modulation im Tumormikromilieu unterstreicht.
Literaturverzeichnis
Bodmer, J.L., Schneider, P. und Tschopp, J., 2002. Die molekulare Architektur der TNF-Superfamilie. Trends in Biochemical Sciences, 27(1), S.19-26.
Wajant, H., 2009. Die Rolle von TNF bei Krebs. Death Receptors and Cognate Ligands in Cancer, S.1-15.
Wajant, H., Pfizenmaier, K. und Scheurich, P., 2003. Signalübertragung durch Tumornekrosefaktor. Cell Death & Differentiation, 10(1), S.45-65.
Van Horssen, R., Ten Hagen, T.L. und Eggermont, A.M., 2006. TNF-α in der Krebstherapie: molekulare Einblicke, antitumorale Effekte und klinischer Nutzen. The Oncologist, 11(4), S.397-408.
Popivanova BK, Kitamura K, Wu Y, Kondo T, Kagaya T, Kaneko S, Oshima M, Fujii C, Mukaida N (2008). Blockierung von TNF-α bei Mäusen reduziert die kolorektale Karzinogenese im Zusammenhang mit chronischer Kolitis. J Clin Invest 118: 560–570
Pikarsky, E., Porat, R.M., Stein, I., Abramovitch, R., Amit, S., Kasem, S., Gutkovich-Pyest, E., Urieli-Shoval, S., Galun, E. und Ben-Neriah, Y., 2004. NF-κB fungiert als Tumor-Promotor bei entzündungsassoziiertem Krebs. Nature, 431(7007), S.461-466.


